現在、CRO(受託臨床試験機関)30数社、SMOも(試験実施機構管理機関)国内には40数社あります。これらの会社すべてが医療用医薬品の日本国内での承認・認可を一日も早く取るためにクライアント企業(製薬会社)からの仕事が殺到しております。しかしながら、なかなか臨床開発経験者が確保できず、調剤薬剤師、製薬会社勤務薬剤師、MR、研究職や病院勤務看護師であれば医薬品臨床開発の経験がなくても20歳代であれば採用しております。この機会に医薬品の開発やCRA(Clinical Research Associate)CRC(Clinical Research Coordinator)のことを理解して頂き、是非チャレンジしてみませんか?
現在の製薬企業の業績を左右するのは、画期的な新薬の開発が必要不可欠となっている。
そのために、製薬企業各社は、画期的新薬の創製のために積極的な研究開発を進めているが、国内市場には、医療保険制度の抜本的改革の行方などから先行き不透明感が深まっている。
こうした厳しい環境の中、製薬企業各社は研究開発を効率的に進めるために以下を中心とした取り組みを進めている。
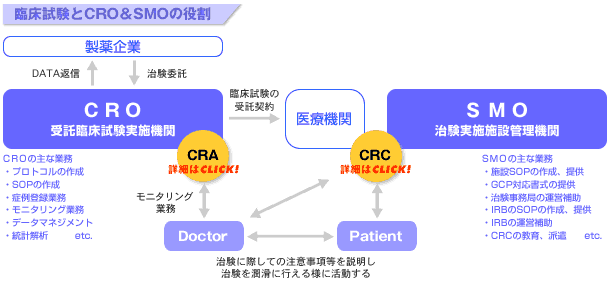
現在CROは医薬品の開発治験を実施するうえで「製薬企業側を支援する企業」として、大きく成長している。
また現在は、ICH(日米欧医薬品規制調和国際会議)の進展により、ドラッグラグの解消の動きとして日・米・EUにおける新薬承認データの相互活用(ブリッジングスタディー)から、三極での同時試験(グローバルスタディー)が中心となり国際規模での競争時代が始まっている。
こういった状況において、市場全体の90%を占める日本CRO協会会員(20社)の売上は、2001年度で約200億円であったが、2013年度は日本CRO協会会員(28社)で1368億円(集計は25社)と7倍近くに伸びている。但し、国内製薬企業のCROのアウトソ-シング率はまだ30%~35%と低く、欧米並みの50%に向け、CRO各社がしのぎを削っている。この背景として製薬各社のパイプラインは大型品が減少する一方、新薬価制度は希少疾患領域やドラッグラグ解消に向けた取り組みにより、今後受託試験が増えるとの見方があり、また経済産業省の周辺産業を育てようとする動きからCRO事業の環境整備も進むと予想される。
CROは以下の業務を製薬企業から受託し治験業務の支援を行っている。
①試験実施計画書(プロトコル)の作成
サンプルサイズの設定、治療法の割り付け、解析方法、調査表の設計等に関してのコンサルティング業務
を行い、質の高い臨床試験が実施できるようにする
②症例登録業務
一般的には、TELやFAXを利用した中央登録方式は症例の適格性が確保され、予後因子を考慮した治療法
の無作為割付が可能です
③モニタリング業務
臨床試験に参加する医療機関を訪問し、担当医師と直接面談し、プロトコル内容の説明、試験進捗状況の
確認、調査表の記入依頼・回収・精査などを行う。
この業務は CRA と呼ばれる職種として注目されている。→CRAとは
④データマネジメント(DM)・統計解析業務
集積された調査表データの入力をはじめ、精査、固定、集計、解析、各種会議用資料の作成など
行うのが主な業務です。
治験は製薬企業と医療機関が協力して実施する。CROが治験関連業務について製薬企業を支援するのに対し、SMOは治験を実施する医療機関を支援する企業として医療機関が携わる治験の各種事務手続きや、治験を実施する医師の業務を支援している。
多くの場合、治験コーディネーター(CRC)を医療機関に派遣し、治験業務の支援を行っている。→CRCとは
2003年4月には『日本SMO協会』が発足し391社が加盟している。(2011年9月現在)
SMOは以下の業務を医療機関に提供することにより治験業務の支援を行っている。
①医療機関での治験を開始するための補助
・施設SOPの作成・提供
・GCP対応書式の提供
・治験責任医師/分担医師、治験協力者の教育
②医療機関での治験を実施するための補助
・治験事務局の立ち上げ
・治験事務局の運営補助
・治験事務局の教育
③IRBの設立・運営の補助
・IRBのSOPの作成・提供
・IRB委員、IRB事務局の教育
・IRBの運営補助
・IRB事務局補助(議事録、審査結果報告書などの作成)
④CRCの教育と派遣
・CRCの教育研修
・CRC業務のフォロー
・バックアップ体制の確保